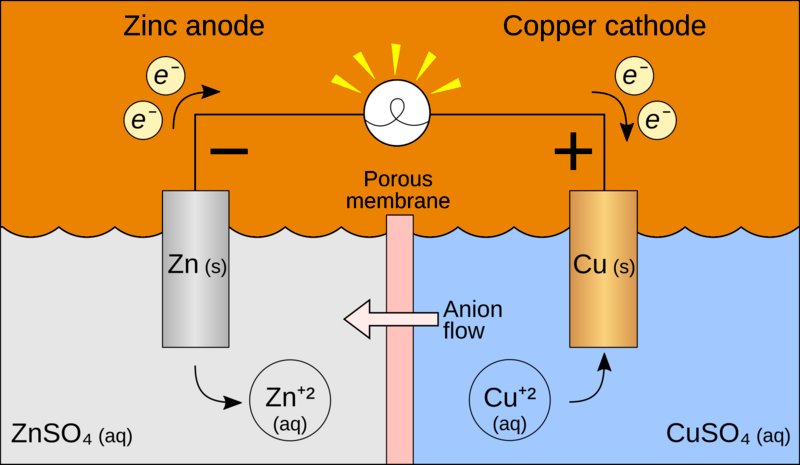
Galvanische Zellen und elektrolytische Zellen sind beide elektrochemische Zellen, aber sie unterscheiden sich in der Art und Weise, wie sie funktionieren und welche Prozesse sie nutzen. Eine galvanische Zelle wandelt chemische Energie in elektrische Energie um. Sie basiert auf einem Redox-System, bei dem eine spontane Redoxreaktion Elektronen von der Anode (wo die Oxidation stattfindet) zur Kathode (wo die Reduktion stattfindet) fließen lässt. Dieser Elektronenfluss erzeugt elektrischen Strom. In einer galvanischen Zelle erfolgt die Reaktion von selbst, ohne dass Energie von außen zugeführt werden muss. Die Anode ist negativ, da sie Elektronen abgibt, und die Kathode ist positiv, weil sie Elektronen aufnimmt.
Im Gegensatz dazu wird in einer elektrolytischen Zelle elektrische Energie verwendet, um eine nicht-spontane chemische Reaktion zu erzwingen. Hier wird Strom von einer externen Quelle in die Zelle geleitet, um die Redoxreaktion auszulösen. Die Anode ist in diesem Fall positiv, weil sie mit der positiven Seite der Stromquelle verbunden ist, und die Kathode ist negativ, da sie mit der negativen Seite verbunden ist. Elektrolytische Zellen werden häufig in Prozessen wie der Elektrolyse verwendet, etwa bei der Zersetzung von Wasser in Wasserstoff und Sauerstoff oder bei der Gewinnung von Metallen aus ihren Erzen.